

发布时间:2021-10-27 10:19:00
2021年9月3日,《eLife》期刊在线发表了《同时过表达Atoh1和Ikzf2促进成年耳蜗支持细胞转分化为外毛细胞》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心刘志勇研究组完成。该研究首次实现了体内原位再生Prestin阳性的外毛细胞。
耳蜗外毛细胞是我们的声音放大器,其特异表达的马达蛋白Prestin(图1A,绿色)能够显著提高我们对外界声音感知的灵敏度。各种耳毒性药物、噪音和衰老等因素均可以造成外毛细胞的损伤(图1B)。低等非哺乳类动物的毛细胞损伤后,其周边的支持细胞能够转分化产生新的毛细胞。但是,人类和其他哺乳类动物均丧失了自我再生毛细胞的能力,临床上外毛细胞损伤最终会导致严重的听力损伤。 Atoh1是耳蜗毛细胞发育过程的一个重要基因。虽然体内过表达Atoh1能把幼年小鼠支持细胞转分化为毛细胞,遗憾的是其无法将成年支持细胞转变为毛细胞(图1C)。因此如何将小鼠成年支持细胞转分化为毛细胞,尤其是表达Prestin、有功能的外毛细胞一直是听觉领域的一个重要但悬而未决的科学问题。
Ikzf2是在耳蜗外毛细胞特异表达的一个基因,其功能突变导致外毛细胞发育障碍。刘志勇研究组提出一个研究假说:同时过表达Atoh1和Ikzf2能够把成年小鼠支持细胞转分化为Prestin阳性的外毛细胞。这个假说最终被实验结果证实(图1C-D):虽然单独Atoh1或者Ikzf2均不能转分化成年小鼠支持细胞,但是Atoh1和Ikzf2一起可以成功地把成年小鼠支持细胞转变为 Prestin阳性的外毛细胞(箭头,图1E-E”)。更令人鼓舞的是,Atoh1和Ikzf2协同转分化效率在外毛细胞损伤的模型中大大提高,达到16%-29%。
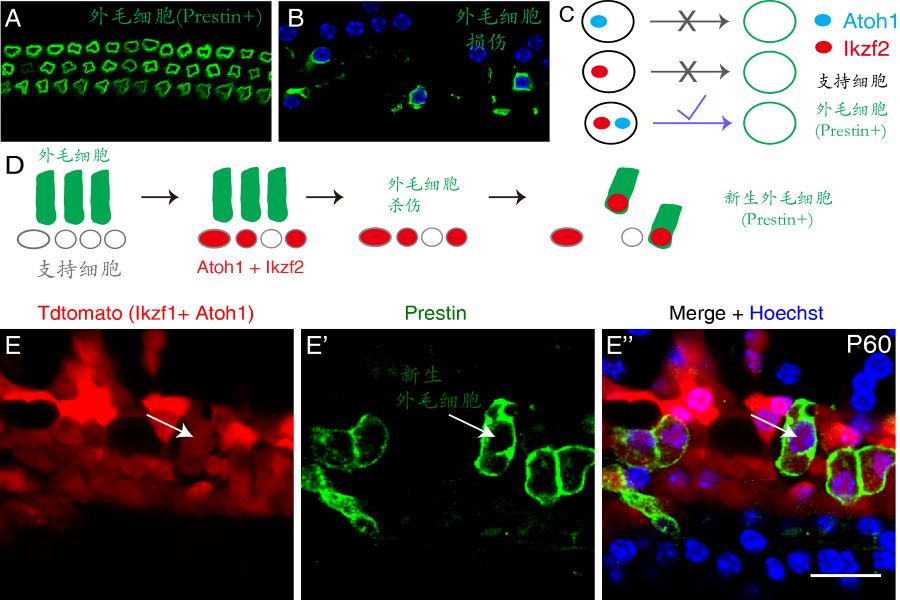
图1 成年耳蜗外毛细胞再生。(A)耳蜗有3排表达马达蛋白Prestin的外毛细胞。(B)外毛细细胞损伤是临床耳聋的一个重要原因。(C)单独过表达Atoh1或者Ikzf2均不能转分化成年耳蜗支持细胞,但是同时过表达它们可以产生Prestin+的新生外毛细胞,实现成年耳蜗支持细胞的转分化。(D)成年外毛细胞再生体内实验的示意图。成年支持细胞在表达Atoh1和Ikzf2的同时,被标记为红色,可以实现后续的谱系追踪分析。(E-E”)箭头所示为一新生外毛细胞,红色代表其初始来源细胞为成年支持细胞,表达了Prestin马达蛋白。
为了进一步确定新生外毛细胞的特征,刘志勇研究组进行了超高分辨率的扫描电镜(图2A和B)和单细胞转录组分析(图2C和D)。研究显示,新生的外毛细胞顶部不仅具有纤毛,而且其基因表达谱也与野生型外毛细胞相似(箭头,图2D),而与内耳其他类型的毛细胞有明显的差别。简而言之,研究人员首次在成年小鼠耳蜗内实现了转分化支持细胞为Prestin阳性的外毛细胞,正如eLife期刊所述,这是耳蜗毛细胞再生领域的一个里程碑式的重要研究成果,其新生外毛细胞的成熟度大大超过了之前的研究,为临床治疗外毛细胞损伤提供了更深入的理论基础。
该工作在听觉系统发育再生研究组刘志勇研究员的指导下,主要由博士研究生孙素红、李书亭和罗正南共同完成。博士研究生任旻蕙负责生物信息学分析;
博士研究生王广琴和工作人员贺顺姬参与了小鼠制备和分析。该研究工作得到了中国科学院脑科学与智能技术卓越创新中心分子平台、光学平台、电镜平台以及实验动物平台的大力支持。该研究得到科技部、中国科学院、自然科学基金委、上海市和德国勃林格殷格翰医药公司等支持。
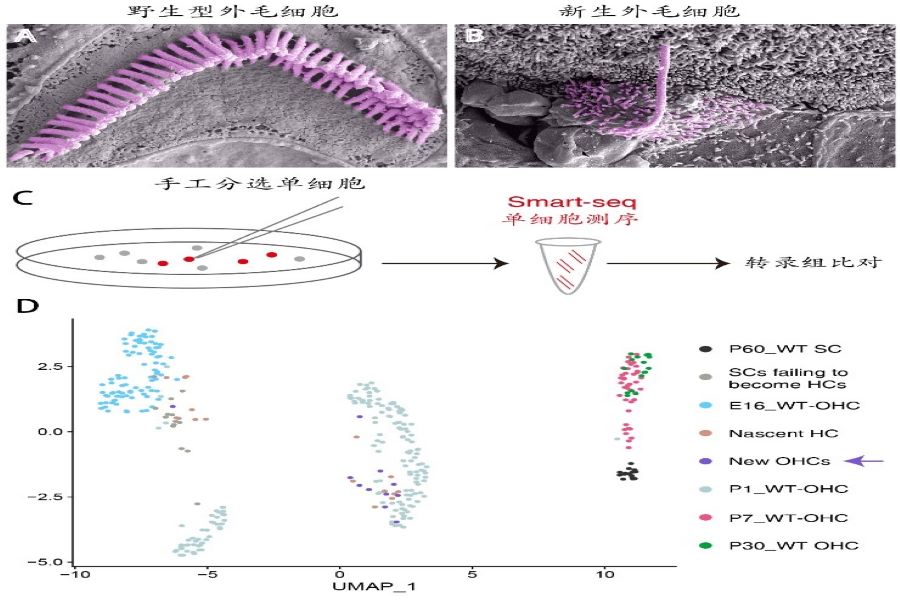
图2 新生外毛细胞超微结构和转录组分析。(A)野生型外毛细胞顶部的纤毛呈V字形。(B)杀伤再生后的新生外毛细胞的纤毛形状不规则。(C)结合手工分选和smartseq单细胞测序的办法进行转录组分析。(D)转录组分析显示新生外毛细胞(紫色箭头)和新生野生型外毛细胞(P1_WT OHC)更接近。
 附件下载:
附件下载: