

发布时间:2019-04-18
为了解决上述问题,实现HDR在体同源重组精准修复对视网膜色素变性等遗传性疾病的治疗,中国科学院脑科学与智能技术卓越创新中心、中国科学技术大学生命科学与医学部薛天教授课题组与中国科学院神经科学研究所仇子龙研究员课题组合作,开发出新型精准基因编辑方法,并结合遗传性视网膜色素变性动物模型,实现了对视网膜色素变性小鼠在体精准基因矫正和视觉修复的治疗。
4月17日,该研究成果以“In vivo genome editing rescues photoreceptordegeneration via a Cas9/RecA-mediated homology-directed repair pathway”(利用Cas9/RecA介导的同源重组修复实现感光细胞退化的在体基因治疗)为题,在线发表于AAAS名下期刊《Science Advances》。才源、程田林、姚艺川为该文章的共同第一作者,薛天、仇子龙、章梅为该文章的共同通讯作者。
在CRISPR/Cas9基础上,创新性引入MS2-RecA复合蛋白系统。RecA为原核表达的可促进同源重组的蛋白酶。通过改造获得具有MS2结合区的向导RNA,使MS2可以与其结合;这样MS2-RecA复合蛋白得以在DNA切割部位附近招募更多的模板DNA,并协助同源重组的发生,从而提高在体同源重组修复的效率。这种利用Cas9/RecA的新型基因编辑方法被称为Targeted-RecA Enhanced homology-Directed repair,简称TRED。
在视网膜色素变性小鼠模型中,科研工作者成功地实现了对视网膜感光细胞的点基因突变修复。在TRED处理后的小鼠中,感光细胞退化得以减弱,小鼠视网膜具有一定感光功能的恢复。
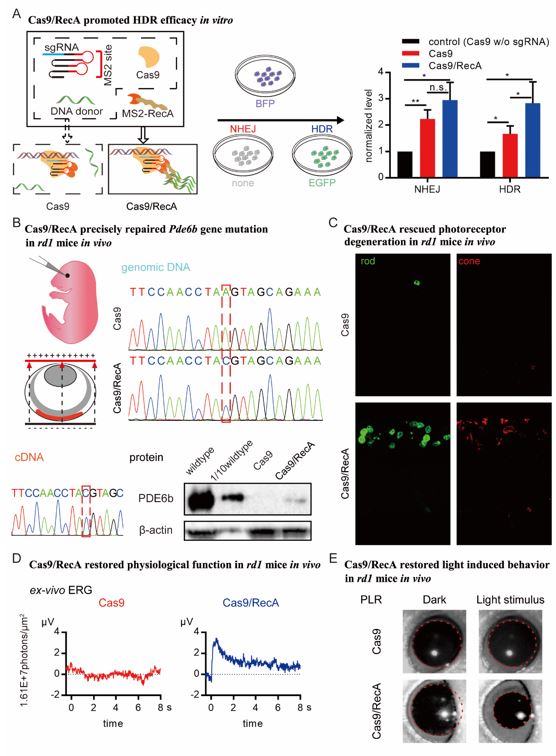
图示为TRED工作原理以及小鼠视网膜在体基因编辑治疗效果
在出生后三天的小鼠中,视网膜中央区的感光细胞分裂能力几乎丧失。TRED依然成功地矫正了非分裂期视杆细胞的基因突变,遏制感光细胞的退化,修复视网膜变性小鼠的部分视觉感光能力。因此TRED新型基因编辑方法在非分裂细胞中同样实现基因矫正和细胞功能修复。
综上所述,新型TRED基因编辑方法有效地实现了出生后非分裂细胞的同源重组基因矫正和相关器官功能修复。由于能够解决非分裂细胞内难以进行同源重组修复的限制,TRED有可能广泛应用于多种人类遗传疾病的在体治疗。
 附件下载:
附件下载: 