

发布时间:2020-05-11
2020年5月8日,《Nature Communications》期刊在线发表了题为《Spider venom-derived peptide induces hyperalgesia in Nav1.7 knockout mice by activating Nav1.9 channels》的研究论文,该研究由湖南师范大学刘中华教授课题组与中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、华中科技大学生命科学与技术学院刘静宇研究组合作完成。该研究通过Nav1.7,Nav1.8,Nav1.9基因敲除小鼠模型,联合运用膜片钳,行为学技术进行分析发现,蜘蛛毒HpTx1抑制Nav1.7、激活 Nav1.9,但不影响 Nav1.8,进而可以恢复Nav1.7基因敲除小鼠痛觉。此研究首次揭示了背根神经节神经元中激活Nav1.9通道可以部分补偿Nav1.7功能缺失以及在动作电位的产生中三个通道之间关系,为进一步治疗Nav1.7相关的先天性无痛症提供了新的方向。
疼痛是人体受到各种伤害性刺激时所产生的感觉。疼痛也是保护机体免受伤害的一种防御性机制,是机体内部的一种警戒系统,而且能够促进损伤组织的愈合。然而Nav1.7功能缺失导致先天性无痛症,对伤害性刺激丧失了警觉。但是对于该病的治疗是一个重大挑战。Nav1.7功能缺失导致先天性无痛症,已有研究表明小鼠Nav1.7缺失导致内源性阿片类物质升高,纳洛酮会阻断该物质的作用,进而小鼠恢复疼痛,而在大鼠体内没有作用。但是,纳洛酮是通过降低内源性阿片类物质间接起作用,会伴有副作用。因此探索新的治疗Nav1.7功能缺失相关先天性无痛症特异性的靶点显得更加重要。
本研究首先通过筛选得到对Nav1.7功能缺失小鼠模型产生致痛作用的多肽毒素,进而发现毒素可以增大Nav1.9电流,但抑制Nav1.7电流。通过Nav1.7基因敲除小鼠模型, Nav1.8基因敲除小鼠模型, Nav1.9基因敲除小鼠模型,Nav1.7/Nav1.8双敲小鼠模型,证明了Nav1.9在小鼠背根神经节神经元中的作用,揭示了毒素HpTx1恢复Nav1.7基因敲除小鼠痛觉的机制和三个通道对动作电位产生的贡献(图a,b)。
该研究为治疗Nav1.7相关的先天性无痛症提供了新的策略和新的靶点,为后续治疗Nav1.7功能缺失的先天性无痛症患者开发药物提供了新思路;通过不同基因敲除小鼠发现Nav1.7、Nav1.8和 Nav1.9三个通道共同精细调节神经元兴奋性,Nav1.9激活可以部分补偿Nav1.7功能缺失(图a,b);首次发现Nav1.9的激动剂并在药理学上证明了Nav1.9在疼痛信号通路传导中的重要角色。
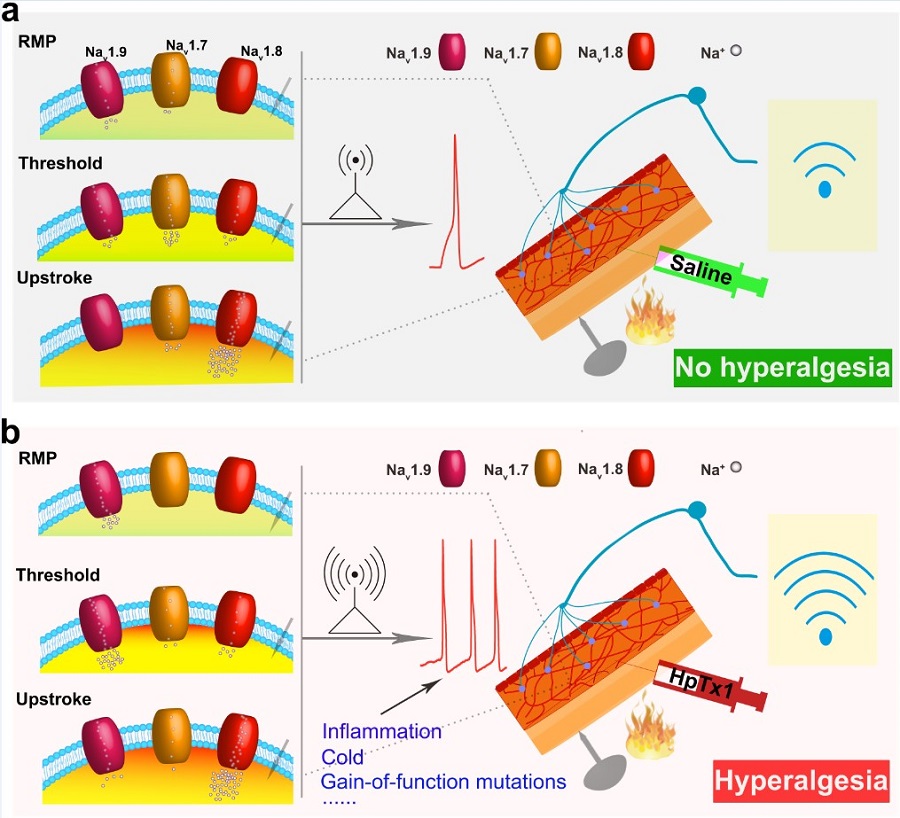
图注(a)正常条件下Nav1.7, Nav1.8, Nav1.9在动作电位产生中的作用。(b)毒素HpTx1处理后Nav1.7, Nav1.8, Nav1.9在动作电位产生中的作用。
湖南师范大学博士周熙和华中科技大学生命科学与技术学院博士研究生马廷斌为共同第一作者,在刘中华教授和刘静宇研究员的指导下完成,研究组的其他成员积极参与,并得到了华中科技大学同济医学院附属同济医院张咸伟教授的大力协助,是众多师生合作的重要成果。
此外,刘静宇研究员与中南大学湘雅二医院施小六教授合作,发现饮酒触发疼痛致病原因是患者同时携带Nav1.9突变和ALDH2的SNP位点p.Glu504Lys,已知ALDH2 p.Glu504Lys改变导致其酶活下降为野生型的6%,携带ALDH2 p.Glu504Lys的疼痛患者饮酒体内累积乙醛;在构建的Nav1.9-KI小鼠疼痛模型中发现醛类物质加剧小鼠疼痛;进一步发现COX2抑制剂能有效缓解Nav1.9突变KI小鼠疼痛表型,COX2抑制剂有可能对携带Nav1.9突变患者疼痛有止痛效果,该工作于2020年4月7日发表在《Pain》期刊上。
上述研究工作得到国家自然科学基金和国家重点研发计划项目资助。
 附件下载:
附件下载: 