

发布时间:2023-09-07
2023年8月29日,《Advanced Materials》期刊在线发表题为Cascade Catalytic Nanoparticles Selectively Alkalize Cancerous Lysosomes to Suppress Cancer Progression And Metastasis的研究论文,该工作由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)刘佳男研究组、复旦大学迟喻丹组、首尔国立大学Taeghwan Hyeon教授组和Jwamin Nam教授组合作完成。
自噬是细胞中高度保守的自行降解过程,细胞将不必要、不正常的部分包裹在囊泡中,转运至溶酶体,进行降解消化。经溶酶体分解消化后的产物可作为能量保障细胞的生长和增殖。正常细胞的自噬过程既起到了清道夫的功能,还起到了废物循环利用的效果。而癌细胞通过调节溶酶体的数量、组成和活性来上调其新陈代谢,以满足细胞生长、增殖、侵袭和转移的需要。在自噬过程中,多种酸性水解酶参与了消化降解过程,水解酶工作的最适pH约为4.5。开发特异性提高肿瘤细胞溶酶体pH值的碱化剂,有望切断肿瘤细胞的营养获取的主要通道,从而抑制肿瘤细胞的增殖和转移。然而,目前尚无肿瘤细胞特异性溶酶体碱化剂的报道。
借助于纳米科技,研究人员首次报道了肿瘤细胞特异性溶酶体碱化剂(LAN: lysosomal alkalizing nanoparticle)。LAN可通过被动靶向效应富集在肿瘤细胞的溶酶体中,将肿瘤微环境过表达的过氧化氢(H2O2)转化为OH-,从而特异性地碱化肿瘤细胞溶酶体。LAN具有核(FexOy纳米颗粒)-卫星(CeO2-z纳米颗粒)结构(图1),水合直径约28 nm。与正常组织相比,肿瘤内H2O2的含量更高。LAN中的内核FexOy纳米颗粒可将H2O2原位转化为 OH,卫星壳层CeO2-z纳米颗粒可立即将产生的 OH转化为OH-。新型溶酶体碱化剂LAN可将肿瘤细胞溶酶体中过量的H2O2转化为OH-,从而碱化溶酶体,达到抑制肿瘤生长和转移的目的。
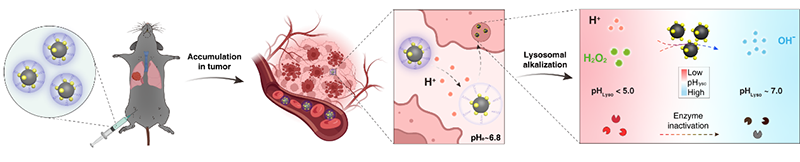
图1. LAN在肿瘤细胞溶酶体富集,通过级联催化反应,使溶酶体脱酸化,从而抑制肿瘤生长和转移。
在过表达H2O2的肺癌肿瘤细胞中,研究人员发现LAN显著提高了溶酶体的pH值,有效弱化了水解酶活性,从而抑制肿瘤细胞的自噬,促进肿瘤细胞凋亡。在正常细胞中,H2O2浓度较低,无法引发LAN级联催化反应,细胞可正常存活和生长。运用高通量测序技术,研究人员进一步探究了LAN介导的肿瘤细胞凋亡机制。LAN有效下调了肿瘤细胞迁移和增殖相关基因的表达,凋亡相关基因表达上调。
研究人员以小鼠的原位肺癌为模型,评价了LAN抗肿瘤的活体效果(图2)。结果显示,无任何处理的LLC肿瘤不仅生长迅速,而且出现明显的对侧肺叶转移。LAN显著抑制了肿瘤的生长,且延长了小鼠的生存期。为了进一步研究LAN抑制肿瘤转移的能力,研究人员构建了肺转移动物模型。对照组模型鼠有明显的脑、肝、心、肾、肺、脾和骨多脏器转移倾向。而在LAN治疗组中的模型中,未见脑、肾脏、肺转移,仅有偶发的骨转移和肝转移。因此,LAN可安全、高效地抑制肿瘤增殖和转移,将在多种癌症治疗中发挥作用,有效推动肿瘤靶向治疗的转化与应用。
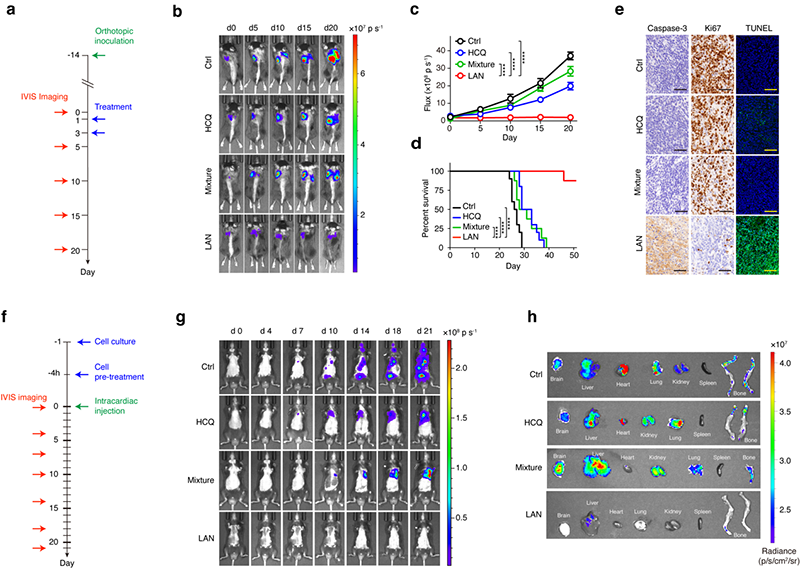
图2. LAN抑制小鼠原位LLC增殖(a-e)和转移(f-h)。
此研究依据人民生命健康的重大需求,力求解决肿瘤靶向治疗的技术瓶颈,充分利用中国科学院脑智卓越中心和复旦大学脑科学转化研究院医工交叉的优势,运用纳米科技,开发了肿瘤细胞特异性碱化剂。该研究不仅为特异性碱化剂的开发提供借鉴性研究思路,而且有望应用于多种溶酶体异常相关疾病的治疗。
该研究在中国科学院脑智卓越中心刘佳男研究员、复旦大学迟喻丹研究员、首尔国立大学Taeghwan Hyeon教授和Jwamin Nam教授的深度合作下,由潘黎敏博士、彭海豹副研究员和博士生Bowon Lee共同完成,中国科学院脑智卓越中心杜久林研究员、研究助理沈秀莲和闫玺镁、博士生滑艺鹏做出了重要贡献。该工作获得国家自然科学基金委员会、科技部、上海市、中国科学院和临港实验室的资助。
 附件下载:
附件下载: 