

发布时间:2021-05-05
2021年5月4日,《神经科学通报》期刊在线发表了题为《孤独症患者中发现的CHD7内含子变异影响神经元分化和发育》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、中国科学院灵长类神经生物学重点实验室、上海脑科学与类脑研究中心仇子龙研究组与陈跃军研究组、上海交通大学附属上海市精神卫生中心杜亚松研究组合作完成。该研究通过对中国孤独症核心家系进行全外显子组测序,发现了一个东亚人群特有的、在中国孤独症家系中富集的、位于CHD7基因内含子的遗传点突变,并发现该点突变通过影响CHD7转录本的可变剪接及调控TBR1基因的表达,导致神经元发育受损。此研究通过一个CHD7遗传性内含子点突变的功能,为常见变异作为孤独症遗传学原因提供了证据支持,揭示了之前未发现的突变机制,为进一步了解孤独症的致病机理及对孤独症进行预测提供了更加广阔的思路。
孤独症是一类婴幼儿时期发病的神经发育性疾病。社交沟通障碍和重复刻板行为是孤独症的核心表型。根据美国疾控防御中心的孤独症和发育性疾病监测网络的统计,孤独症的发病率逐年上升,目前估计每58个出生的孩子就有一个患有孤独症。全世界对孤独症的关注和研究越来越广泛。
对双生子和家系的研究一致表明,孤独症的遗传力非常大。对于孤独症的致病基因研究,发现了100多个风险基因可以新发有害突变,很多功能明确的基因突变可以单独致病,但影响孤独症的遗传因素,新发和罕见遗传的有害突变只能解释10-20%的孤独症,而遗传并且功能较弱的常见变异,占据孤独症很大比例。不同地域人群SNP是有差异的。因此针对更广泛的样本筛选孤独症相关的特异SNP并对其功能进行研究,将为孤独症的致病基因和致病机制提供不可或缺的证据。
仇子龙研究组与杜亚松研究组合作,收集了167个中国孤独症家系,提取外周血基因组进行全外显子组测序,根据一套流程筛选风险突变,再通过Sanger测序验证突变的存在,筛选到了位于CHD7的一个点突变(图A)。
为研究该点突变是否产生与CHD7缺失相关的功能缺陷,仇子龙研究组与陈跃军研究组合作,使用CRISPR/Cas9介导同源重组方法,构建含有CHD7内含子点突变的干细胞。将点突变干细胞分化为神经元的过程中,发现CHD7表达降低、神经分化迟滞以及神经元形态缺陷。通过对比分化神经元的转录组,发现携带有CHD7内含子变异的分化神经元中,基因TBR1表达水平显著升高,TBR1是重要的ASD风险基因。为了验证点突变神经元的缺陷是否由于TBR1表达水平改变所导致,作者通过在正常细胞中敲减CHD7水平,发现TBR1表达水平上调,这与点突变细胞中的变化一致;作者进一步将分化的点突变神经元中的TBR1表达敲低,发现神经元的形态缺陷被挽救。结果表明点突变神经元的缺陷确实由TBR1表达水平改变所导致。为了进一步研究点突变是如何发挥作用的,作者对CHD7的转录本进行分析,发现除正常转录本外,还有三种异常形式的转录本出现(图B),并且发现异常形式的转录本在神经元中不具有正常转录本的功能。
该工作发现了一个中国孤独症家系中富集的、位于CHD7基因内含子的遗传点突变,验证了其对神经发育的功能及机制,为常见变异作为孤独症遗传学原因提供了证据支持,为进一步了解孤独症的致病机理及对孤独症基因进行预测提供了基础。
该项工作由仇子龙组博士研究生张然、助理研究员袁博与陈跃军组博士研究生何慧共同完成,吴子彦博士与王秀臻博士做出了重要贡献,本工作得到中科院、科技部、基金委、上海市的资助。
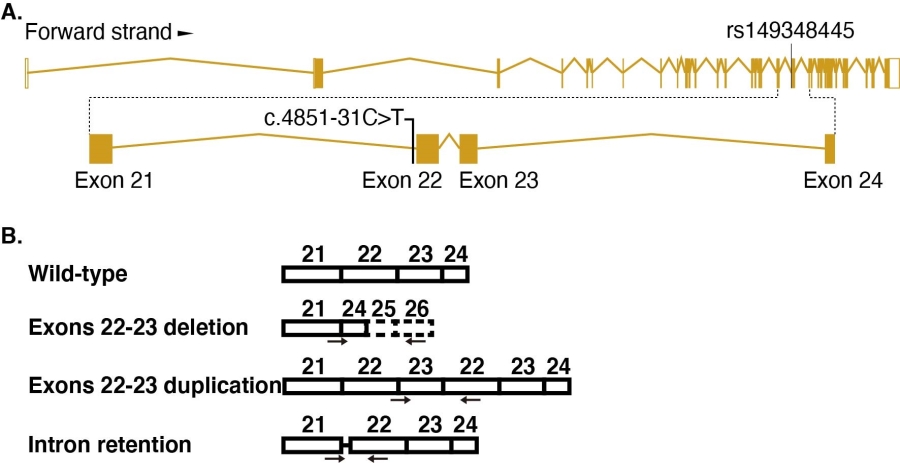
图注(A)点突变示意图。(B)可变剪接示意图。
 附件下载:
附件下载: 