

发布时间:2023-10-02
2023年10月1日,《Cell Reports》 期刊在线发表了题为 《CDKL5 deficiency in adult glutamatergic neurons alters synaptic activity and causes spontaneous seizures via TrkB signaling》 的研究论文,由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心熊志奇研究组和上海交通大学医学院附属精神卫生中心朱永川研究组合作完成。
CDKL5缺乏症(CDKL5 deficiency disorder,CDD)是由位于X染色体的CDKL5基因功能缺失性突变导致的神经发育疾病,主要症状包括早发性癫痫、刻板动作以及认知与运动障碍等。CDD患者主要为女性,发病率约为四万分之一,2023年该病被纳入中国第二批罕见病目录。2003年中国学者陶炯与合作导师德国马普分子遗传研究所Vera Kalscheuer教授在智力障碍伴婴儿痉挛患者中发现了CDKL5基因的突变。2004年陶炯教授回国后与熊志奇研究员合作开启了CDKL5的功能研究,克隆了啮齿类动物的同源基因,揭示了CDKL5在大脑中的时空表达特征,并在2010年最早报道CDKL5在神经元形态发育中的作用与机制。
早发性难治性癫痫发作是CDD患儿的典型症状,首次发作通常出现在出生后3个月内,给患者和家庭带来沉重的身心负担。早期的CDD动物模型,如Cdkl5基因全敲除以及致病突变敲入小鼠均未表现出癫痫发作。2021年,熊志奇研究组率先发现,在出生早期条件性敲除前脑兴奋性神经元中的Cdkl5基因能导致小鼠自发性癫痫发作,这改变了当时领域内普遍的观点,即CDD模型小鼠无法体现类似临床的癫痫症状。尽管在CDD小鼠模型中重现了癫痫发作的表型,但这些小鼠存在发作时间延迟、进程慢等问题。在本项研究中,研究人员发现,在成年小鼠中特异性敲除前脑兴奋性神经元中的Cdkl5基因能够使所有小鼠在两周后出现自发性癫痫发作,而在发育期诱导敲除Cdkl5基因则发作癫痫的小鼠比例大大下降。这表明小鼠脑发育过程中的代偿效应可能是影响出现癫痫表型的重要原因,绕过发育过程在成年大脑失活CDKL5是建立CDD癫痫模型的关键。
利用新构建的CDD癫痫小鼠模型,研究人员发现脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达在癫痫发作之前增加,其受体TrkB及下游信号分子亦存在过度激活,这导致了海马齿状回突触前囊泡释放概率增大、兴奋性突触传递增强。利用遗传学手段敲除一个拷贝的TrkB编码基因来降低TrkB的表达能够阻止CDD小鼠的癫痫发生与发展。更具有临床意义的是,在已经发作癫痫的小鼠中,通过药理学手段抑制TrkB受体的活性显著减少了癫痫发作。这些结果表明,BDNF-TrkB信号通路在CDD癫痫小鼠模型里的异常激活是导致兴奋性突触传递增强和癫痫发作的重要机制。
熊志奇团队致力于推动CDKL5缺乏症的基础与临床研究,与患儿家长们发起成立了中国CDKL5互助联盟和希舞关爱之家。 团队揭示了CDKL5在神经元迁移和树突/轴突生长中的重要作用 (Chen et al., 2010),CDKL5在兴奋性突触中的作用和机制(Zhu et al., 2013),以及CDKL5自身磷酸化在神经元发育和可塑性中的功能 (Jiang et al., 2023),并且在国际上首次构建了具有显著自发癫痫表型的CDD小鼠模型,发现了潜在的药物干预靶点 (Wang et al, 2021;Zhu et al., 2023),奠定了中国科学家在CDKL5缺乏症研究领域的国际引领地位。
该研究在中国科学院脑智卓越中心熊志奇高级研究员和上海交通大学医学院附属精神卫生中心朱永川研究员的指导下,由朱姊艾博士和李奕彦博士共同完成。中国科学院脑智卓越中心动物平台实验师胥娟、熊志奇组博士生薛慧以及封雪博士对该研究做出了重要贡献。中国科学院脑智卓越中心光学成像平台、分子细胞技术平台和实验动物平台提供了技术支持。该研究获得了中国科学院、科技部、基金委以及上海市的资助。
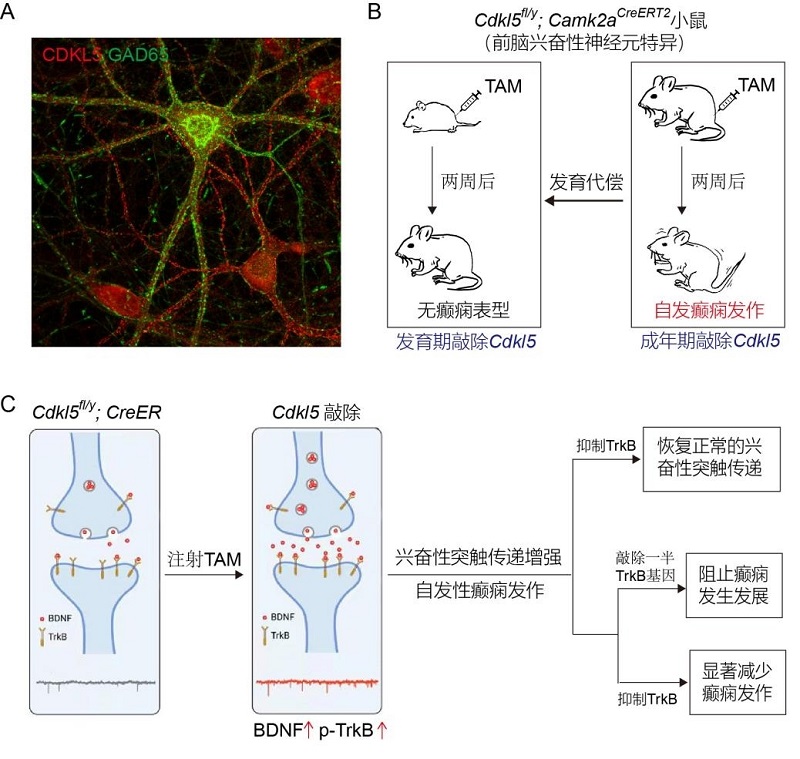
图1. CDKL5功能缺失通过BDNF-TrkB信号通路引起自发性癫痫发作
A. CDKL5(红色)在兴奋性神经元和GAD65阳性抑制性神经元(绿色)中表达。
B. 成年小鼠前脑兴奋性神经元中敲除Cdkl5基因引起自发性癫痫发作。
C. BDNF-TrkB参与CKDL5功能缺失引起的兴奋性突触增强和自发性癫痫发作。敲除一半的TrkB编码基因能够阻止癫痫的发生和发展;而在癫痫发作开始后抑制TrkB活性能够显著减少癫痫发作。
 附件下载:
附件下载: 