发布时间:2021-01-05
2021年1月5日,《Nature Cell Biology》期刊在线发表了题为《通过内源性启动子驱动的sgRNA监测低丰度转录本和lncRNAs的表达》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室杨辉研究组和周海波研究组合作完成。该研究通过内源基因的启动子驱动sgRNA(single-guide RNAs)表达,结合SPH-OminiCMV(CRISPR-activator Suntag-P65-HSF1 and OminiCMV-mCherry)荧光报告系统,成功实现低丰度基因和lncRNAs(Long non-coding RNAs)基因表达的动态示踪。该研究建立了一种通用的内源基因转录门控系统,为活细胞中实时标记低表达基因和lncRNAs,研究其生物学功能提供了有效工具。
在活细胞中实时监测内源基因活性对于研究基因的生物学功能并调控其表达水平至关重要。近年来越来越多证据表明,lncRNAs通过调控某些重要编码基因的表达,不仅参与了脑发育、神经元分化、突触可塑性的发生发展,而且参与神经系统损伤之后的修复过程。深入研究lncRNAs,将为治疗神经系统疾病提供新思路。但是受现有标记技术的限制,对其功能注释极具挑战性。
监测内源基因活性的常规方法是将荧光蛋白精确插入蛋白编码框中,但是,这种方法并不适用于非编码基因和低丰度转录的基因。sgRNA,类似于一个GPS可以将Cas核酸酶直接导向目标核酸位点,具有高特异性、高效率和多功能性。尽管各种诱导性sgRNA已经被开发用来接收活细胞中的内源信号,但这些方法只能用于某些功能明确的小RNA的反应。目前在活细胞里面标记内源基因表达的方法,都具有一定的局限性,而且,对于低表达的基因以及lncRNA,目前缺乏很好的活细胞内的标记技术。 建立适用范围更广,能增强内源信号,并且信噪比更低的新型活细胞标记技术,是该研究领域急需解决的问题。
杨辉研究组和周海波研究组合作开发了一种广谱的内源性转录门控开关Ents(Endogenous Transcription-Gated Switch),利用内源性启动子表达sgRNA前体,之后sgRNA前体上的tRNA序列可以被内源的自剪切机制识别并且切割,进而释放出能够执行功能的sgRNA,当Ents与高度敏感的CRISPR激活相关的报告系统SPH-OminiCMV结合,可以监测到内源基因的表达(图A)。值得注意的是,SPH-OminiCMV-Ents能够放大内源信号,从而实现低丰度转录本表达的可视化。
为进一步研究SPH-OminiCMV-Ents用于监测内源基因的能力,团队选取了表达量从高到低的八个基因,发现SPH-OminiCMV-Ents诱导的mCherry表达水平普遍高于常用的P2A-mCherry标记策略,尤其是P2A-mCherry策略标记后在荧光显微镜下几乎无信号的低丰度表达基因Sox2、Tet1、Sall4、Tbx3等(图B)。
为探讨增加sgRNA拷贝数是否会进一步增强荧光蛋白的产生,团队构建了一个sgRNA前体,包含六到八个串联的sgRNA拷贝,每个sgRNA的两侧分布着tRNA序列(图C)。研究表明,插入sgRNA阵列可以对低丰度基因实现更好的监测,比如lncRNA Tug1,当仅用一个拷贝的sgRNA的时候不能监测到其表达,但使用sgRNA阵列则可以(图D,E)。
为进一步探讨此方法的特性,团队成员建立了一个可控的Tet-on系统,该系统可以通过调节Dox的浓度,实现EGFP基因不同程度的表达量,进而用来研究报告系统的荧光信号强度是否可以很好地反映目标基因的表达水平。研究发现,报告系统的mCherry表达量和EGFP基因的表达量有很强的相关性,并且进一步探索了此报告系统和目标基因表达在转录本水平和蛋白翻译水平存在的时间差(图F)。
为探讨此系统是否能够随着基因表达量的增高,其报告系统也能监测出信号增强的变化。团队选取了表达量在小鼠胚胎干细胞中表达量低,但体外分化成神经元后表达量会增高的Tubb3基因。实验结果显示,分化后Tubb3的基因表达量不管是mRNA还是蛋白水平的表达量均增高,报告系统中的红色荧光信号也随之增高,能够反映基因表达的动态变化。
该研究创新开发了由内源性启动子驱动的高度可编程的sgRNA门控开关Ents,此系统理论上可以处理任何转录本的信息。研究人员将Ents与SPH-OminiCMV结合使用,在小鼠胚胎干细胞水平上实现了对低丰度基因和lncRNA的可视化监测及其动态变化的监测。该研究为在活细胞中研究基因元件的功能开辟了新途径,在动物个体水平可用于描绘基因表达的时空图谱和标记、鉴定特定的细胞类群,同时可用于研究天使综合症等疾病中lncRNA的表达模式,构建lncRNA体内表达完整图谱。
该研究由博士研究生高妮、博士后胡静、贺冰冰、硕士研究生基正邦,以及博士后胡新德,在杨辉研究员和周海波研究员的共同指导下完成,研究组的其他成员积极参与。该研究得到了脑智卓越中心基因编辑平台、分子流式平台、光学成像平台的大力支持,获得中国科学院、国家自然科学基金委、上海市科委的资助。
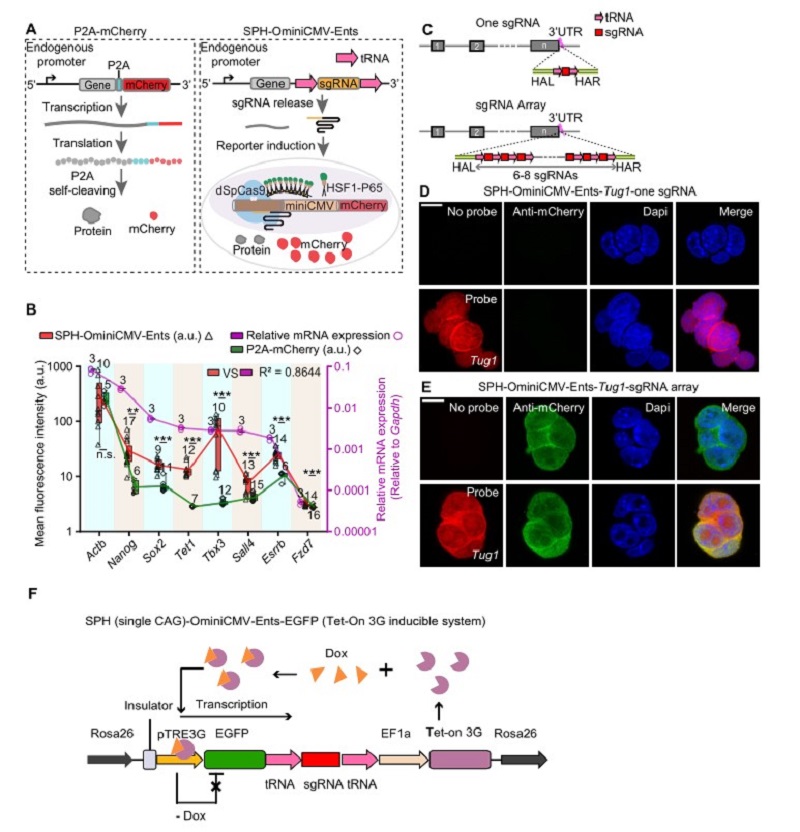
图注1:(A)示意图显示P2A-mcherry和SPH-OminiCMV-Ents两种标记基因的策略。(B)在mESC细胞中用SPH-OminiCMV-Ents策略(红色三角形)和P2A- mCherry策略(绿色菱形)标记不同的基因,统计其mCherry荧光信号强度以及用qPCR分析这些基因的表达水平(紫色圆圈,紫色y轴)。(C)示意图显示插入一个sgRNA或一个sgRNA阵列的标记策略。(D,E)Fish图像显示对lncRNA Tug1在3'UTR中插入一个sgRNA或一个sgRNA阵列后,细胞系中mCherry报告荧光信号的表达情况。(F)可控的Tet-on系统示意图,Dox诱导EGFP-sgRNA前体转录,成熟的sgRNA释放出来激活mcherry报告系统。
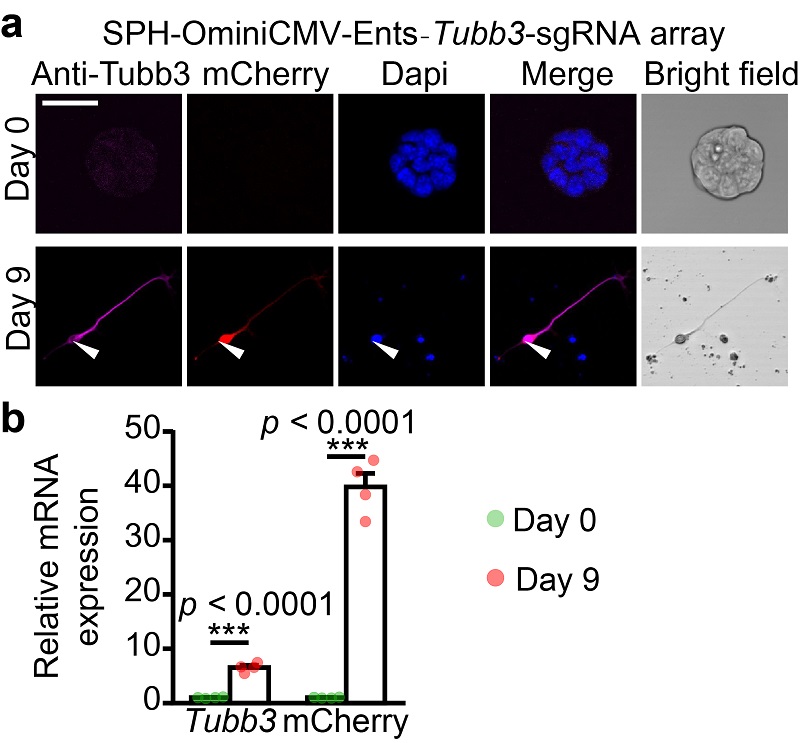
图注2:(A)在小鼠的胚胎干细胞上标记Tubb3基因,体外分化成神经元后,Tubb3基因表达量升高,标记到的红色报告荧光也从极低到高。(B)分化前和分化后Tubb3基因和报告荧光信号在mRNA水平升高的量化统计。
研究组之前的研究成果——SPH激活系统:
 附件下载:
附件下载: