

发布时间:2023-09-08
2023年9月7日,《Nature Metabolism》期刊在线发表了中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室周海波研究组题为《Alleviating symptoms of neurodegenerative disorders by astrocyte-specific overexpression of TMEM164 in mice》的研究论文。该研究鉴定出跨膜蛋白TMEM164是神经毒性星形胶质细胞激活过程中的关键调控因子,在星形胶质细胞中特异性过表达TMEM164不仅可以在体外抑制神经毒性状态星形胶质细胞的激活并维持星形胶质细胞的正常功能,同时可以在阿尔茨海默病和帕金森病小鼠模型中降低活化的星形胶质细胞的神经毒性并减轻相关神经退行性疾病的表型。
星形胶质细胞在不同的脑疾病条件下会转变为不同的活化状态。例如在脑缺血模型中,星形胶质细胞表现为神经保护性亚型。而在神经炎症条件下,炎症性小胶质细胞能通过分泌IL-1 , TNF和C1q三种因子诱导星形胶质细胞激活为神经毒性亚型,而神经毒性星形胶质细胞的激活可能与众多神经退行性疾病和衰老的发生密切相关。
尽管之前的研究已经揭示了神经毒性星形胶质细胞激活的原因和诱导神经元死亡的机制,但是调控神经毒性星形胶质细胞激活的关键因子还没有被鉴定,从而限制了开发通过特异性调控神经毒性星形胶质细胞激活来缓解神经退行性疾病的成体治疗策略。
为了筛选调控神经毒性星形胶质细胞激活的关键靶点,研究人员通过整合分析神经毒性星形胶质细胞激活、去激活和再激活过程中的转录组测序数据,以及多种神经退行性疾病病人大脑的单细胞核测序数据,鉴定出跨膜蛋白TMEM164是神经毒性星形胶质细胞激活过程中的早期反应因子,并且可能与多种神经退行性疾病的发生密切相关。在体外培养的小鼠和人星形胶质细胞中过表达TMEM164可以抑制神经毒性状态星形胶质细胞的激活,基本维持星形胶质细胞正常的细胞吞噬(图1A和B)和促进神经元突触生长(图1C和D)的功能,并且抑制由神经毒性星形胶质细胞诱导的神经元死亡(图1E和F),证明过表达TMEM164具有神经保护性作用。
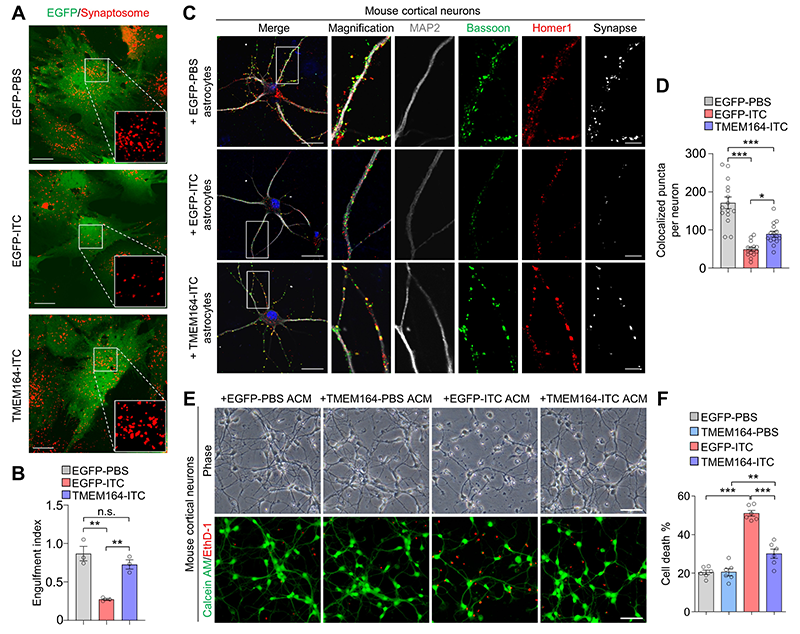
图1. 跨膜蛋白TMEM164调控神经毒性星形胶质细胞的激活。(A-B)TMEM164过表达维持星形胶质细胞在炎症条件下的细胞吞噬功能。(C-D)TMEM164过表达基本维持星形胶质细胞在炎症条件下促进神经元突触生长的功能。(E-F)TMEM164过表达抑制由神经毒性星形胶质细胞条件培养基诱导的神经元死亡。
为了进一步证明在体内星形胶质细胞中过表达TMEM164的神经保护性作用,研究人员开发了一种能高效且特异性的抑制特定脑区甚至全脑的神经毒性星形胶质细胞激活的AAV治疗策略,并在AD和PD小鼠模型发病过程中成功阻止了神经毒性星形胶质细胞的活化和神经元的死亡(图2)。
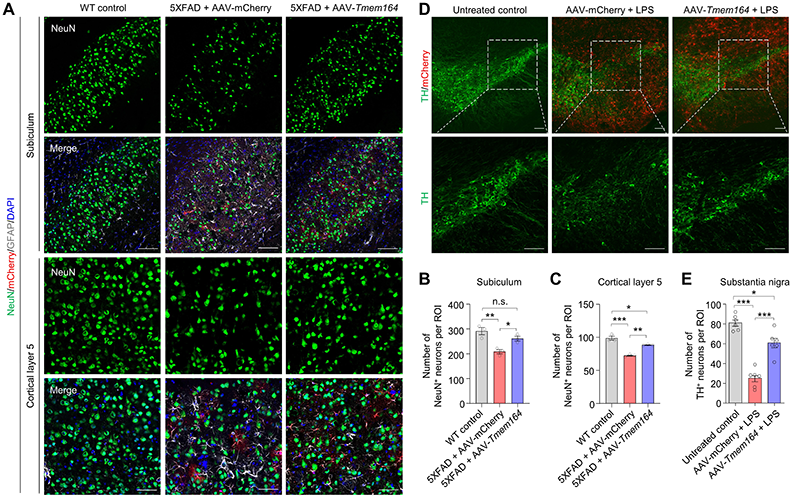
图2. AAV介导的星形胶质细胞特异性过表达TMEM164抑制AD和PD小鼠模型中的神经元死亡。(A-C)AAV介导的全脑星形胶质细胞特异性过表达TMEM164抑制5XFAD小鼠大脑海马下托和皮层第五层的神经元死亡。(D-E)AAV介导的星形胶质细胞特异性过表达TMEM164抑制LPS诱导的PD小鼠模型大脑黑质区的神经元死亡。
该研究首次证明了跨膜蛋白TMEM164在神经系统中调控星形胶质细胞激活的功能,并开发出基于AAV介导的星形胶质细胞特异性过表达TMEM164的治疗神经退行性疾病的策略,为包括阿尔茨海默病和帕金森病在内的多种神经退行性疾病的临床干预提供了新的治疗靶点和成体治疗策略。
中国科学院脑智卓越中心张连升博士、博士研究生贾芷蘅和博士研究生吴强为该论文共同第一作者。中国科学院脑智卓越中心周海波研究员及其实验室许争争博士为该论文共同通讯作者。中国科学院脑智卓越中心刘真研究员、柏涛博士、王博博士、傅吉强博士、助理实验师刘星宇,上海鲸奇生物科技有限公司胡新德博士,复旦大学华山医院李天文博士,以及中国科学院干细胞库丁小燕研究员和陈跃磊博士为本研究提供了重要帮助。中国科学院脑智卓越中心光学成像平台、分子细胞技术平台和实验动物平台对本研究提供了技术支持。该研究得到科技部、中国科学院、上海市科委、上海类脑中心和神经科学国家重点实验室“揭榜挂帅”项目的资助。
 附件下载:
附件下载: 